Biologie-Schule.de
Das Nachschlagewerk für Biologie

Atommasse, Symbol und Ordnungszahl
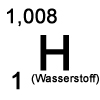 Wasserstoff ist ein natürlich vorkommendes Element mit dem Elementsymbol H und der Ordnungszahl 1.
Im Periodensystem steht es mit einer Atommasse von 1,008 u in der 1. Hauptgruppe.
Das von Henry Cavendish 1766 entdeckte chemische Element ist nicht radioaktiv und befindet sich bei
Raumtemperatur in einem gasförmigen Aggregatszustand.
Wasserstoff ist ein natürlich vorkommendes Element mit dem Elementsymbol H und der Ordnungszahl 1.
Im Periodensystem steht es mit einer Atommasse von 1,008 u in der 1. Hauptgruppe.
Das von Henry Cavendish 1766 entdeckte chemische Element ist nicht radioaktiv und befindet sich bei
Raumtemperatur in einem gasförmigen Aggregatszustand.
Steckbrief: Wasserstoff (engl. Hydrogen)
 Allgemeines Allgemeines | |
|---|---|
| Chemisches Element: | Wasserstoff |
| Symbol: | H |
| Ordnungszahl: | 1 |
| Gruppe: | 1 |
| Periode: | 1 |
| Block: | s-Block |
| Serie: | Nichtmetalle |
| Aussehen: | farblos |
| Entdecker: | Henry Cavendish |
| Jahr der Entdeckung: | 1766 |
 Atomare Eigenschaften Atomare Eigenschaften | |
| Atommasse: | 1,008 u |
| Atomradius: | 25 pm |
| Kovalenter Radius: | 31 pm |
| Van-der-Waals-Radius: | 120 pm |
| Elektronenkonfiguration: | 1s1 |
| Ionisierungsenergie: | 1312 kJ/mol |
 Physikalische Eigenschaften Physikalische Eigenschaften | |
| Aggregatzustand: | gasförmig |
| Dichte: | ??? |
| Kristallstruktur: | / |
| Magnetismus: | diamagnetisch |
| Molvolumen: | 11,42 · 10-6 m3/mol |
| Mohshärte: | / |
| Schmelzpunkt: | -259 °C |
| Siedepunkt: | -252 °C |
| Schmelzwärme: | 0,55 kJ/mol |
| Verdampfungswärme: | 0,90 kJ/mol |
| Wärmeleitfähigkeit: | 0,18 W |
 Chemische Eigenschaften Chemische Eigenschaften | |
| Elektronegativität: | 2,2 |
Kurzsteckbrief
Wasserstoff (lateinisch: hydrogenium) ist das häufigste Element im Sonnensystem und das neunthäufigste in der Erdkruste. Der Masseanteil in der Erdhülle beträgt ca. 0,9 %. Der englische Chemiker und Physiker Henry Cavendish entdeckte im Jahre 1766 das chemische Element bei Experimenten mit Säuren. Heutzutage wird Wasserstoff zu industriellen Zwecken mit unterschiedlichsten Verfahren gewonnen, darunter zählen zum Beispiel Kohlevergasung, Partielle Oxidation oder Wasserelektrolyse.
Wasserstoff verfügt über eine Atommasse von 1,008 u und einem Atomradius von 25 pm, wobei der kovalente Radius 31 pm beträgt. Der Van-der-Waals-Radius beträgt 120 pm. Die genaue Massendichte ist unbekannt. Bei einer Raumtemperatur von 20 °C befindet sich das chemische Element in einem gasförmigen Aggregatszustand. Der Schmelzpunkt von reinem Wasserstoff liegt bei einer Temperatur von -259 °C. Ab -252 °C beginnt Wasserstoff vom flüssigen in den gasförmigen Aggregatszustand überzugehen (Siedepunkt). Die Wärmeleitfähigkeit liegt bei 0,18 W, womit Wasserstoff ein verhältnismäßig sehr schlechter Wärmeleiter ist. Das Element ist bei Raumtemperatur diamagnetisch. Die Mohshärte von reinem Wasserstoff ist wegen des gasförmigen Zustandes bei Raumtemperatur nicht bestimmbar. Insgesamt sind zwei stabile Wasserstoffisotope bekannt (1H, 2H). Mindestens fünf weitere instabile Isotope wurden bislang wissenschaftlich beschrieben. Die Elektronegativität nach der Pauling-Skala liegt bei 2.2.
Schon gewusst, dass ...
- Wasserstoff auf der Erde nicht in Form von atomarem Wasserstoff (H) vorkommt, sondern nur als gebundenes Molekül (H2)?
- Wasserstoff im Universum das häufigste Element darstellt?
- elementarer Wasserstoff kein Neutron besitzt?
- Wasserstoff trotz seiner leichten Explosionsgefahr früher als Ballongas genutzt wurde?
- Wasserstoffbomben mehr Energie freisetzen als auf Uran basierende Atombomben?
- man Wasserstoff mittels der Knallgasprobe nachweisen kann?
- Wasserstoff bereits 1766 durch den Chemiker Henry Cavendish entdeckt wurde?
Weiterführende Links