Biologie-Schule.de
Das Nachschlagewerk für Biologie

Was sind die Gruppen des Periodensystems?
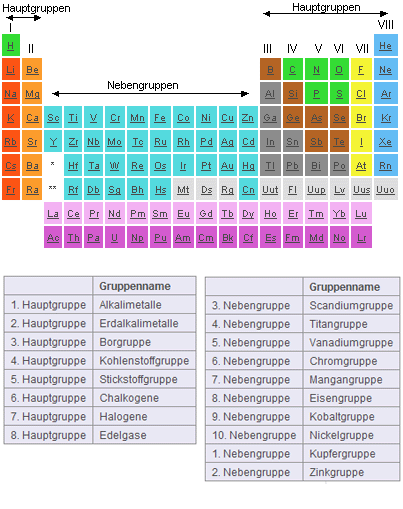
Das Periodensystem der Elemente besteht aus insgesamt 18 Gruppen, aufgeteilt in acht Hauptgruppen (Alkalimetalle,
Erdalkalimetalle, Borgruppe, Kohlenstoffgruppe, Stickstoffgruppe, Chalkogene, Halogene und Edelgase) und zehn Nebengruppen (Kupfergruppe, Zinkgruppe,
Scandiumgruppe, Titangruppe, Vanadiumgruppe, Chromgruppe, Mangangruppe, Eisengruppe, Kobaldgruppe, Nickelgruppe).
Demnach bildet jede Spalte im Periodensystem eine eigenständige Gruppe. Eine Ausnahme stellen hierbei die beiden Pseudogruppen der Lanthanoide und Actinoide dar.
Innerhalb einer Gruppe verfügen sämtliche chemischen Elemente über die identische Anzahl
an Außenelektronen (Valenzelektronen).
Eigenschaften der Hauptgruppen:
Alkalimetalle: Lithium, Natrium, Kalium, Rubidium, Cäsium und Francium gehören zu den Alkalimetallen. Das chemische Element Wasserstoff gehört zwar in vielen Darstellungen in die erste Gruppe, weist aber keinerlei Eigenschaften ebendieser auf. Elemente dieser Gruppe verfügen über eine geringe Schmelztemperatur, eine geringe Dichte, reagieren mit Wasser und Luft und kommen in der Natur nur in chemischen Verbindungen vor.
Erdalkalimetalle: Zur Erdalkalimetallgruppe gehören Beryllium, Magnesium, Calcium, Strontium, Barium und Radium. Die Elemente der zweiten Gruppe sind metallisch glänzend, weich und weisen eine sehr gute elektrische Leitfähigkeit auf. In der Regel kommen die Elemente als zweiwertige Kationen vor.
Borgruppe: Bor, Aluminium, Gallium, Indium und Thallium gehören zur Borgruppe. Sie kommen häufig in Sauerstoffverbindungen vor und sind wenig bis nicht leitfähig. Bis auf Bor ähneln die chemischen und physikalischen Eigenschaften denen der Erdalkalimetallgruppe.
Kohlenstoffgruppe: Die Kohlenstoffgruppe bestehend aus Kohlenstoff, Silicium, Germanium, Zinn und Blei, weist eher heterogene physikalische Eigenschaften auf, da sie sowohl Metalle als auch Nicht-Metalle beinhaltet.
Stickstoffgruppe: Die Elemente Stickstoff, Phosphor, Arsen, Antimon und Bismut sind bei Raumtemperatur - mit Ausnahme von Stickstoff - fest. Chemische und physikalische Eigenschaften weisen eine große Schwankungsbreite auf, da die Stickstoffgruppe Nichtmetalle (N, P), Halbmetalle (As, Sb) und Metalle (Bi) beinhaltet.
Chalkogene: Sauerstoff, Schwefel, Selen, Tellur und Polonium reagieren leicht mit Metallen zu Metallchalkogeniden. Sie kommen oft in Verbindung mit Mineralien und Erzen vor.
Halogene: Die Elemente Fluor, Chlor, Brom, Iod, Astat sind farbig in ihrer Erscheinung, leiten keinen elektrischen Strom und sind äußerst reaktionsfreudig.
Edelgase: Helium, Neon, Argon, Krypton, Xenon und Radon gehören zur Gruppe der Edelgase. Alle sind geruchlos, äußerst reaktionsträge und kommen nur in ihrer elementaren Form vor.
Zusammenfassung
- Das Periodensystem besteht aus acht Haupt-, sowie zehn Nebengruppen. Jede Spalte bildet eine eigene Gruppe.
- Lanthanoide und Actinoide bilden zwei seperate Pseudogruppen.