Biologie-Schule.de
Das Nachschlagewerk für Biologie

Atommasse, Symbol und Ordnungszahl
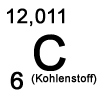 Kohlenstoff ist ein natürlich vorkommendes Element mit dem Elementsymbol C und der Ordnungszahl 6.
Im Periodensystem steht es mit einer Atommasse von 12,011 u in der 4. Hauptgruppe.
Das chemische Element ist nicht radioaktiv und befindet sich bei Raumtemperatur in einem festen Aggregatszustand.
Kohlenstoff ist ein natürlich vorkommendes Element mit dem Elementsymbol C und der Ordnungszahl 6.
Im Periodensystem steht es mit einer Atommasse von 12,011 u in der 4. Hauptgruppe.
Das chemische Element ist nicht radioaktiv und befindet sich bei Raumtemperatur in einem festen Aggregatszustand.
Steckbrief: Kohlenstoff (engl. Carbon)
 Allgemeines Allgemeines | |
|---|---|
| Chemisches Element: | Kohlenstoff |
| Symbol: | C |
| Ordnungszahl: | 6 |
| Gruppe: | Kohlenstoffgruppe |
| Periode: | 2 |
| Block: | p-Block |
| Serie: | Nichtmetalle |
| Aussehen: | farblos |
| Entdecker: | / |
| Jahr der Entdeckung: | urzeitlich |
 Atomare Eigenschaften Atomare Eigenschaften | |
| Atommasse: | 12,011 u |
| Atomradius: | 70 pm |
| Kovalenter Radius: | 76 pm |
| Van-der-Waals-Radius: | 170 pm |
| Elektronenkonfiguration: | [He] 2s2 2p2 |
| Ionisierungsenergie: | 1086,5 kJ/mol |
 Physikalische Eigenschaften Physikalische Eigenschaften | |
| Aggregatzustand: | fest |
| Dichte: | 2,460 g/cm3 |
| Kristallstruktur: | kubisch |
| Magnetismus: | diamagnetisch |
| Molvolumen: | 3,42 · 10-6 m3/mol |
| Mohshärte: | 10 |
| Schmelzpunkt: | ??? |
| Siedepunkt: | ??? |
| Schmelzwärme: | ??? |
| Verdampfungswärme: | 715 kJ/mol |
| Wärmeleitfähigkeit: | ??? |
 Chemische Eigenschaften Chemische Eigenschaften | |
| Elektronegativität: | 2,55 |
Kurzsteckbrief
Kohlenstoff (lateinisch: carbonium) ist das vierthäufigste Element im Sonnensystem und das 13. häufigste in der Erdkruste. Der Masseanteil in der Erdhülle beträgt ca. 0,09 %. Bereits in der frühesten Geschichte der Menschheit war Kohlenstoff den Menschen schon bekannt. Kohlenstoff findet sich in der Natur sowohl als elementarer Kohlenstoff (z.B. Diamant oder Graphit), als auch in chemischen Verbindungen wieder (z.B. Kohlenstoffdioxid, Kohle, Erdöl, Erdgas).
Kohlenstoff verfügt über eine Atommasse von 12,011 u und einem Atomradius von 70 pm, wobei der kovalente Radius 76 pm beträgt. Der Van-der-Waals-Radius beträgt 170 pm. Die Massendichte beträgt 2,460 g/cm3. Bei einer Raumtemperatur von 20 °C befindet sich Kohlenstoff in einem festen Aggregatszustand. Der Schmelzpunkt von reinem Kohlenstoff liegt bei einer Temperatur von ca. 3500 °C. Ab 4800 °C beginnt Kohlenstoff vom flüssigen in den gasförmigen Aggregatszustand überzugehen (Siedepunkt). Die Wärmeleitfähigkeit ist abhängig vom Zustand, in dem sich der Kohlenstoff befindet. Das Element ist bei Raumtemperatur diamagnetisch. Die Mohshärte von reinem Kohlenstoff kann - je nach Zustand - zwischen 0,5 (Grafit) und 10 (Diamant) schwanken. Insgesamt sind zwei stabile Kohlenstoffisotope bekannt (12C, 13C). Mindestens 15 weitere instabile Isotope wurden bislang wissenschaftlich beschrieben. Die Elektronegativität nach der Pauling-Skala liegt bei 2.55.
Schon gewusst, dass ...
- Diamanten aus reinem Kohlenstoff bestehen und zugleich das härteste Element darstellen?
- Desoxyribonukleinsäure (DNA) Kohlenstoffatome enthält?
- alle Lebewesen aus Kohlenstoffverbindungen bestehen?
- Graphit ebenso wie Diamant lediglich aus Kohlenstoff besteht aber ganz andere Eigenschaften aufweist? (Mohshärte von Graphit = 1, von Diamant = 10)
- Bleistiftminen aus Graphit bestehen?
- die Radiokarbonmethode, zur Datierung von totem organischen Material, auf dem Zerfall von 14C-Atomen basiert?
Weiterführende Links