Biologie-Schule.de
Das Nachschlagewerk für Biologie

Atommasse, Symbol und Ordnungszahl
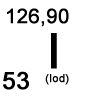 Iod ist ein natürlich vorkommendes Element mit dem Elementsymbol I und der Ordnungszahl 53.
Im Periodensystem steht es mit einer Atommasse von 126,90 u in der 7. Hauptgruppe.
Das von Bernard Courtois 1811 entdeckte chemische Element ist nicht radioaktiv und befindet sich bei
Raumtemperatur in einem festen Aggregatszustand.
Iod ist ein natürlich vorkommendes Element mit dem Elementsymbol I und der Ordnungszahl 53.
Im Periodensystem steht es mit einer Atommasse von 126,90 u in der 7. Hauptgruppe.
Das von Bernard Courtois 1811 entdeckte chemische Element ist nicht radioaktiv und befindet sich bei
Raumtemperatur in einem festen Aggregatszustand.
Steckbrief: Iod (engl. Iodine)
 Allgemeines Allgemeines | |
|---|---|
| Chemisches Element: | Iod |
| Symbol: | I |
| Ordnungszahl: | 53 |
| Gruppe: | Halogengruppe |
| Periode: | 5 |
| Block: | p-Block |
| Serie: | Halogene |
| Aussehen: | grau bis violett |
| Entdecker: | Bernard Courtois |
| Jahr der Entdeckung: | 1811 |
 Atomare Eigenschaften Atomare Eigenschaften | |
| Atommasse: | 126,90 u |
| Atomradius: | 140 pm |
| Kovalenter Radius: | 139 pm |
| Van-der-Waals-Radius: | 198 pm |
| Elektronenkonfiguration: | [Kr] 4d10 5s2 5p5 |
| Ionisierungsenergie: | 1008,4 kJ/mol |
 Physikalische Eigenschaften Physikalische Eigenschaften | |
| Aggregatzustand: | fest |
| Dichte: | 4.933 g/cm3 |
| Kristallstruktur: | orthorhombisch |
| Magnetismus: | diamagnetisch |
| Molvolumen: | 25,72 · 10-6 m3/mol |
| Mohshärte: | ??? |
| Schmelzpunkt: | 113 °C |
| Siedepunkt: | 184 °C |
| Schmelzwärme: | 7,76 kJ/mol |
| Verdampfungswärme: | ??? |
| Wärmeleitfähigkeit: | 0,44 W |
 Chemische Eigenschaften Chemische Eigenschaften | |
| Elektronegativität: | 2,66 |
Kurzsteckbrief
Iod (lateinisch: iodum) ist das 52. häufigste Element im Sonnensystem und das 70. häufigste in der Erdkruste. Der Masseanteil in der Erdhülle beträgt ca. 0,06 ppm. Bereits im Altertum vor etwa 3000 v. Chr. war das Halogen den Menschen als Arznei bekannt. Doch erst im Jahr 1811 wurde Iod vom französischen Sodafabrikanten Bernard Courtois aus Algen isoliert. Heutzutage wird Iod hauptsächlich als Nebenprodukt bei der Herstellung von Salpeter gewonnen. Die größten Förderer von Iod sind Chile, Japan und die USA.
Iod verfügt über eine Atommasse von 126,90 u und einem Atomradius von 140 pm, wobei der kovalente Radius 139 pm beträgt. Der Van-der-Waals-Radius beträgt 198 pm. Die Massendichte von Iod beträgt 4.933 g/cm3. Bei einer Raumtemperatur von 20 °C befindet sich Iod in einem festen Aggregatszustand. Der Schmelzpunkt von reinem Iod liegt bei einer Temperatur von 113 °C. Ab 184 °C beginnt Iod vom flüssigen in den gasförmigen Aggregatszustand überzugehen (Siedepunkt). Die Wärmeleitfähigkeit liegt bei 0,44W, womit Iod ein verhältnismäßig sehr schlechter Wärmeleiter ist. Die Kristallstruktur ist orthorhombisch. Das Element ist bei Raumtemperatur diamagnetisch. Die Mohshärte von reinem Iod liegt bei 3,5 und ist damit auf der Skala nach Friedrich Mohs als mittel einzuschätzen. Insgesamt ist nur ein stabiles Iodisotop bekannt (127I). Mindestens 43 weitere instabile Isotope wurden bislang wissenschaftlich beschrieben. Die Elektronegativität nach der Pauling-Skala liegt bei 2.66.
Schon gewusst, dass ...
- Iod zum desinfizieren eingesetzt wird?
- Schilddrüsenkrankheiten in direkter Verbindung mit der Iodversorgung des Körpers stehen?
- man im 18. Jahrhundert Iod aus Seetang gewann?
- Iod im gasförmigen Zustand eine violette Farbe annimmt?
- von über 40 bekannten Isotopen nur das Isotop 127I natürlich auf der Erde vorkommt?
Weiterführende Links